保健食品清理換證近20年艱難落地之路及換證審評內容
2023-09-13
自2023年8月31日國家市場監管總局發布《 允許保健食品聲稱的保健功能目錄 非營養素補充劑(2023年版)》及其配套解讀文件后,很多企業咨詢我們“清理換證”的相關問題,為使大家對其有更清晰、全面的理解,以便穩步推進換證工作,我們整理本篇分享給大家,今天發布第一部分《保健食品清理換證近20年艱難落地之路及換證審評內容》,明天發布第二部分《保健食品清理換證96-05年7000余“雙無”產品清單》。
清理換證落地之路
早在2004年國家相關部門即已開始謀劃“清理換證”。回顧歷史,“清理換證”政策落地一路走來甚為艱難,時間跨越近20年,歷經原國家食品藥品監督管理局(SFDA)、原國家食品藥品監督管理總局(CFDA)和國家市場監督管理總局(SAMR)。
01、SFDA時代
2004年12月24日,原國家食品藥品監督管理局藥品注冊司下發《關于開展保健食品注冊有關情況調查的通知》(食藥監注函[2004]152號),開啟清理換證摸底普查之路。
2005年3月30日,國務院辦公廳關于印發《2005年全國食品藥品專項整治工作安排的通知》(國辦發〔2005〕20號)提及:“認真開展保健食品清理、換證工作”。
2005年9月20日,原國家食品藥品監督管理局(SFDA)下發《保健食品清理換證方案(征求意見稿)》。
2005年11月24日,原國家食品藥品監督管理局(SFDA)再發布征求《保健食品清理換證方案(送審稿)》意見的通告,附件1中列出29個已撤銷保健食品批準證書的清單。
2009年7月21日,原國家食品藥品監督局發布《關于開展保健食品基本情況調查和確認工作的通知(食藥監辦許函[2009]280號) 》,表示將適時開展保健食品產品清理換證和再注冊工作,對衛生部和國家局批準的保健食品產品基本情況進行調查摸底和確認。
2010年5月5日,原國家食品藥品監督局(SFDA)印發《2010年保健食品安全整頓工作實施方案》,表示:“待《保健食品監督管理條例》出臺后,依法對獲批注冊但未標明有效期的保健食品進行全面清理換證。”
2012年9月18日,原國家食品藥品監督局(SFDA)發布《保健食品清理換證工作方案(征求意見稿)》意見的函(食藥監保化函[2012]425號)。
02、CFDA時代
2013年3月14日,根據第十二屆全國人民代表大會第一次會議審議通過的《國務院機構改革和職能轉變方案》,組建國家食品藥品監督管理總局(CFDA),不再保留國家食品藥品監督管理局(SFDA)。
2015年3月25~26日,全國保健食品監督管理工作會議在北京召開,會議指出“完善注冊、備案管理制度,全面啟動清理換證”。
2015年10月1日,新食安法正式實施。
2016年2月26日,國家食品藥品監督管理總局(CFDA)發布《保健食品注冊與備案管理辦法》解讀,第十七條:“對現有已批準注冊的保健食品,采取分期分批、依法合規、穩步推進的原則開展清理換證工作。通過清理換證,使新老產品審評標準保持一致。清理換證方案另行規定。”
03、SAMR時代
2018年3月13日,根據第十三屆全國人民代表大會第一次會議審議通過的《國務院機構改革方案》,組建國家市場監督管理總局(SAMR),不再保留國家食品藥品監督管理總局(CFDA)。
2019年8月20日,國家市場監管總局召開專題新聞發布會,介紹《保健食品標注警示用語指南》和《保健食品原料目錄與保健功能目錄管理辦法》總體情況,表示會有序開展換證清理工作。
2022年1月13日,國家市場監管總局(SAMR)發布《關于發布允許保健食品聲稱的保健功能目錄 非營養素補充劑(2022年版)及配套文件》的公告(征求意見稿),納入新舊功能的銜接措施,即俗稱的“清理換證”。
2023年8月31日,國家市場監管總局發布《允許保健食品聲稱的保健功能目錄 非營養素補充劑(2023年版)》,配套解讀文件中明確了“老功能聲稱”和“雙無”產品過渡要求,至此“清理換證”終于落地。
清理換證審評內容
根據《 允許保健食品聲稱的保健功能目錄 非營養素補充劑(2023年版)》及其配套解讀文件(以下簡稱“23版功能目錄”),保健功能調整為24個,較之03版,刪除“改善生長發育”、“促進泌乳”和“改善皮膚油分”。設置5年過渡期,企業需在5年內完成換證工作。
01、“老功能聲稱”產品
對于列入23版功能目錄的產品,相對簡單,僅僅規范保健功能聲稱,企業可單獨提出功能名稱變更,也可在辦理其他變更、延續等事項時規范;在審產品審評機構將直接調整,企業無需操作;對于未列入23版功能目錄的產品,可申請納入(難度巨大)或放棄此功能去變更23版目錄內功能。
02、“雙無”產品
“雙無”產品主要是指2005年7月1日前原衛生部和國家食品藥品監督管理局(SFDA)批準的保健食品,其頒發的保健食品批準證書未注明證書的有效期,也無技術要求。據健研申訊最新統計,原衛生部自1996年11月4日至2003年7月8日,共批準5200個(含已注銷/撤消產品),其中衛食健字4749個,衛食健進字237個,衛進食健字214個;原國家食品藥品監督管理局(SFDA)自2003年10月完成原衛生部移交工作、正式啟動保健食品審批工作至2005年7月1日前,共計批準2132個。因此,“雙無”產品總共估計7000余個,占到目前批準功能產品的1/3以上,涉及企業4700余家,可見清理換證規模之龐大,影響之廣泛,將會對保健食品批文格局以及市場產生重大變化和深遠影響。也由此不難理解,清理換證落地之所以歷時近20年之久,工作之繁重,任務之艱巨,牽一發而動全身。在此向為推動清理換證落地付出艱苦卓越努力的國家局、各地省局以及協會、專家等致敬!
據悉,“清理換證”將采取分期分批、依法合規、穩步推進的原則開展清理換證工作,最終使新老產品審評標準保持一致。“雙無”產品需首先通過省級市場監管部門意見,對于在生產產品,會優先處理,而未進行過實際生產“閑置”產品換證之路或許較為艱難坎坷,我們建議有條件的企業可咨詢各地省局考慮盡快落證生產。另外,原功能依據為96版評價方法的產品,有8個功能需補做功能試驗,建議企業盡快送檢,在檢驗期間同步進行換證其他工作,以縮短換證周期。
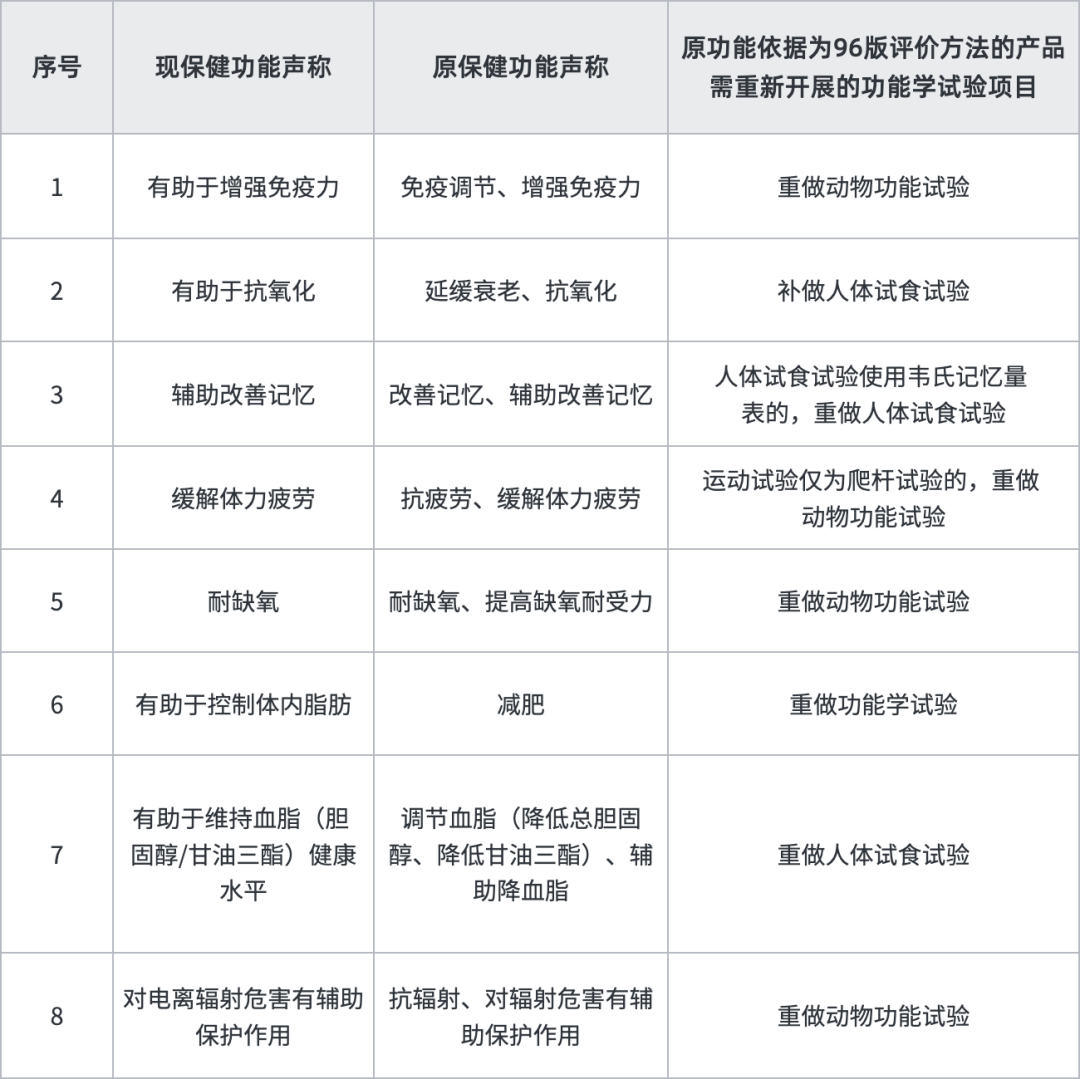
按照我們經驗,換證審評除上述明確補做內容外,將會對保健食品產品名稱、說明書(如標示值、服用量、適宜人群等)、技術要求(如標志性成分,提取物工藝等)及生產工藝按照新法規進行審評予以規范,比如:不屬于普通食品、新食品原料、食品添加劑及可用物品名單內的原料或用量不符合現行規定的需提供食用安全的文獻等資料或要求調整用量;無標志性成分或標志性成分檢測方法不符合現行規定的,需補訂標志性成分以及提供方法學驗證資料;產品技術要求缺少指標的須按國家現行標準增訂,增訂指標屬于穩定性重點指標的還需要提供三批穩定性報告。存在以下情形者預計將不予換證:(1)未在規定時限內提出換證申請或補充資料未在規定時限內提交或不符合要求;(2)原輔料、產品不符合現行規定(比如原料為一級野生動植物保護品種或其他禁用物品),存在食用安全問題的;(3)生產工藝無法重現,不符合現行規定的;(4)國家相關部門已撤銷的保健食品批準證書。
保健食品清理換證服務
很多企業比較關心換證費用和周期,這需要根據每個產品不同情況做出具體分析,費用少則免費,多則幾十萬,周期少則幾個月,多則三四年。近幾年我們已幫助一些先行的企業進行換證相關工作,以變更事項遞交,獲得寶貴的審評意見和經驗,歡迎企業與我們交流,我們會對換證產品進行全面評估和分析,提供經濟、可行、保障的換證方案,依法合規、穩步推進,從而確保5年內順利換證!

